|
|
|
| 中国海洋大学在海鞘天然产物抗肿瘤机制领域取得新进展 |
| http://www.huaue.com 2025年12月17日 来源:华禹教育网 |
|
12月13日,中国海洋大学方宗熙海洋生物进化与发育研究中心董波教授团队在综合性学术期刊Advanced Science(《先进科学》)上发表了题为“Halorotetin
B, a novel terpenoid compound derived from marine
ascidian, suppresses tumor growth by targeting the cell
cycle regulator UBE2C”(真海鞘素B,一种新型海鞘来源的萜类化合物,通过靶向细胞周期调控因子UBE2C抑制肿瘤生长)的最新研究成果。该研究鉴定得到了一个未被报道的新颖抗肿瘤萜类化合物,通过靶向细胞周期调控蛋白UBE2C抑制肿瘤增殖,为海鞘来源抗肿瘤药物研发提供了重要科学基础。
癌症的高发病率及死亡率严重危害人类健康,发展药效强、毒副作用小的小分子化疗药物被认为是癌症治疗的有效策略。天然产物因其结构的新颖性和化学多样性,被认为是抗肿瘤药物发现的重要来源。真海鞘(Halocynthia roretzi)是一种含有丰富营养物质的可食用海鞘,课题组前期研究表明,真海鞘含有大量的附属微生物,这种特性,使其具有生产多种次级代谢产物的潜力。目前,仅有少数真海鞘来源的活性天然产物的报道。因此,课题组利用真海鞘为原材料,挖掘具有抗肿瘤活性的天然产物,从而为抗肿瘤药物及其先导化合物的开发提供理论基础。
在本研究中,研究人员以肿瘤细胞毒性为导向,筛选具有抑制肿瘤细胞增殖功能的活性组分。通过天然产物化学方法,对真海鞘来源的抗肿瘤天然产物进行提取、分离、纯化以及结构鉴定,得到了一个结构新颖、药效突出的萜类抗肿瘤天然产物-Halorotetin B(图A)。体外抗肿瘤实验表明该化合物能够显著抑制多种肿瘤细胞的增殖,且对正常细胞毒性较小(图B)。同时,体内药效学结果显示该化合物亦能够显著抑制肿瘤生长(图C)。进一步抗肿瘤作用机制研究表明,Halorotetin B影响肿瘤细胞周期信号通路(图D)。通过化学蛋白质组学与转录组学结合的方法,鉴定得到Halorotetin B的靶蛋白为细胞周期调控蛋白-UBE2C(图E)。Halorotetin B通过直接结合UBE2C,抑制其下游靶蛋白,Cyclin B1和Securin的泛素化降解,诱导肿瘤细胞周期阻滞,进而诱导肿瘤细胞衰老,抑制肿瘤增殖(图F)。
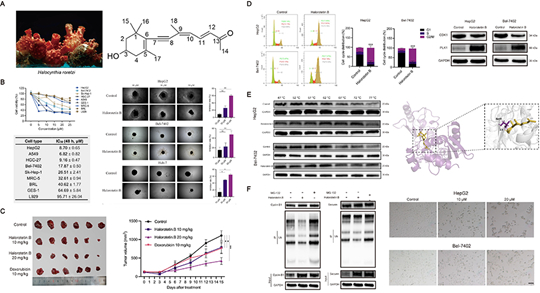
图1.新型海鞘来源的萜类化合物通过靶向细胞周期调控因子UBE2C抑制肿瘤生长。(A) 真海鞘来源的天然抗肿瘤化合物Halorotetin B。(B) Halorotetin B体外抑制肿瘤细胞及肿瘤细胞球增殖。(C) Halorotetin B体内抑制肿瘤生长。(D) Halorotetin B诱导肿瘤细胞周期阻滞。(E) 细胞周期调控蛋白UBE2C为Halorotetin B的直接作用靶点。(F) Halorotetin B通过靶向UBE2C诱导肿瘤细胞周期阻滞及肿瘤细胞衰老。
肿瘤靶向治疗的成功经验表明,新治疗靶点的发现对于开发有前景的抗肿瘤药物至关重要。最近的研究表明,针对泛素-蛋白酶体系统可能是开发抗肿瘤药物的一种潜在策略。几种针对泛素-蛋白酶体系统的小分子抑制剂已被报道,如靶向Cdc34的别构抑制剂-CC0651和靶向UbcH5c的DHPO。UBE2C,作为E2泛素结合酶,在多种肿瘤组织中均呈现出高表达的特征,与肿瘤的增殖、转移以及化疗药的耐药性有关,靶向UBE2C可能是一种控制肿瘤进展的有前景的策略。目前,还未有直接、高效的小分子UBE2C抑制剂的报道。因此,作为一种新颖的小分子UBE2C蛋白抑制剂,Halorotetin B具有开发成为癌症治疗药物的巨大潜力和研发前景。

论文第一作者韩善浩
中国海洋大学博士生韩善浩为该论文第一作者,董波教授为通讯作者。医药学院邵长伦教授、青岛海洋生物医药研究院杨金波教授、邱培菊老师、吴丽娟老师对本项目提供了重要帮助与支持。研究工作得到了国家重点研发计划项目和山东省泰山学者工程等项目资助。
文:韩善浩
文章链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202515652
|
 关于中国海洋大学更多的相关文章请点击查看 关于中国海洋大学更多的相关文章请点击查看  |
|
| 特别说明:由于各方面情况的不断调整与变化,华禹教育网(Www.Huaue.Com)所提供的信息为非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性,仅供参考,相关信息敬请以权威部门公布的正式信息为准。 |
|
|
|
| |